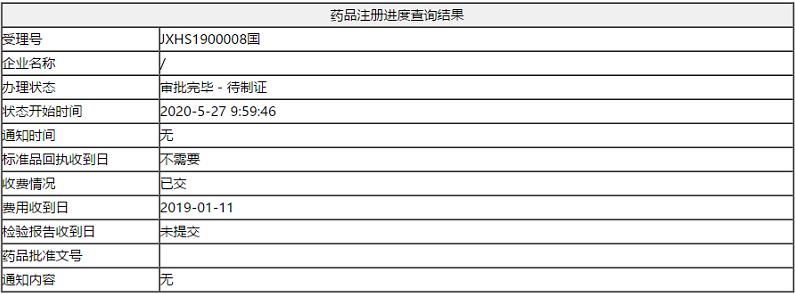
2020年5月28日,诺华肿瘤(中国)宣布,中国国家药品监督管理局(NMPA)批准诺华肿瘤口服小分子ALK抑制剂塞瑞替尼胶囊 (商品名:赞可达),单药适用于间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者。自此,塞瑞替尼再添一新适应症,入局ALK阳性局部晚期或转移性非小细胞肺癌患者的一线治疗,为医生提供了新选择,为患者带来切实获益。(受理号:JXHS1900008)。
近年来,肺癌在中国的发病率及死亡率位均列恶性肿瘤的第一位,高达85%以上的肺癌为非小细胞肺癌,其中的ALK阳性患者占NSCLC患者的3%-7%,在亚裔非吸烟的年轻人群中较为常见,被诊断时大都已处于疾病晚期。不过,ALK重排是一个重要的驱动基因,携带ALK重排的患者可从靶向ALK激酶的酪氨酸激酶抑制剂治疗中获益。塞瑞替尼作为首个进入中国的二代ALK抑制剂,首次获批适应症针对此前接受过克唑替尼治疗后进展的或者对克唑替尼不耐受的ALK阳性的局部晚期或者转移性NSCLC患者。
本次适应症获批是基于ASCEND系列研究,其中ASCEND-4和ASCEND-8研究结果奠定了塞瑞替尼在中国一线治疗ALK阳性晚期非小细胞肺癌的地位。在早期ASCEND-4临床研究中,塞瑞替尼采用750 mg空腹给药的用药方式,一线治疗获得的中位无进展生存期(PFS)为16.6个月,亚洲人群获得无进展生存期(PFS)为26.3个月。而在ASCEND-8临床研究中,塞瑞替尼450 mg随餐的给药方式下疗效得到了大幅度提升。目前,最长随访时间已经超过25个月,中位PFS仍未达到。同时,450mg随餐给药方式的客观缓解率(ORR)达到78%。 在塞瑞替尼450mg随餐剂量下,药物的安全性和治疗依从性得到了显著提升,相对剂量强度从83.7%提高到100%,同时,药物的药物经济学也得到了大幅度的提升。相信塞瑞替尼以450mg随餐剂量获批了更为广泛的适应症,将为医生治疗肺癌带来新的武器,为患者带来更多希望与获益。